
- 抑制剂
- 化合物库
- 热卖化合物库
- 定制您的化合物库
- 临床和上市相关
- 活性化合物总库
- 抑制剂相关
- 天然产物和药食同源相关
- 代谢相关
- 细胞死亡相关
- 按信号通路分类
- 按疾病分类
- 抗感染和抗病毒相关
- 神经和免疫相关
- 片段和共价相关
- FDA药物库
- 临床I期后及FDA药物库
- 临床前和临床药物库
- 已知活性药物库-I
- 生物活性库Ⅱ
- 激酶抑制剂库
- 多样性化合物母核库
- 天然产物库
- 人内源代谢化合物库
- 生物碱类化合物库New
- 血管生成相关化合物库
- 抗衰老化合物库
- 抗阿尔茨海默病化合物库
- 抗生素化合物库
- 抗肿瘤化合物库
- 抗癌化合物库-Ⅱ
- 抗癌代谢化合物库
- 抗心血管疾病化合物库
- 抗糖尿病化合物库
- 抗感染化合物库
- 抗氧化化合物库
- 抗寄生虫药物库
- 抗病毒化合物库
- 凋亡分子化合物库
- 自噬化合物库
- 钙通道阻滞剂库New
- Cambridge抗癌化合物库
- 糖代谢化合物库New
- 细胞周期化合物库
- 血脑屏障通透化合物库
- 共价抑制剂库
- 细胞因子抑制剂库New
- 细胞骨架信号通路化合物库
- DNA损伤/ DNA修复化合物库
- 类药性化合物库
- 内质网应激库
- 表观遗传化合物库
- 外泌体分泌相关化合物库New
- FDA抗癌药物库New
- 铁死亡化合物库
- 黄酮类化合物库
- 片段库
- 谷氨酰胺代谢化合物库
- 糖酵解化合物库
- GPCR小分子化合物库
- 肠道微生物代谢物库
- HIF-1信号通路化合物库
- 高选择性抑制剂库
- 组蛋白修饰化合物库
- 新药发现高通量筛选库
- 人类激素相关化合物库New
- 人转录因子化合物库New
- 免疫/炎症分子化合物库
- 抑制剂库
- 离子通道配体库
- JAK-STAT信号通路库
- 脂代谢化合物库New
- 大环化合物库
- MAPK抑制剂库
- 药食同源化合物库
- 代谢化合物库
- 甲基化化合物库
- 小鼠代谢化合物库New
- 天然有机化合物库
- 神经信号化合物库
- NF-κB信号通路库
- 核苷类似物库
- 肥胖化合物库
- 氧化应激化合物库New
- 植物提取物库
- 表型筛选库
- PI3K/Akt 抑制剂库
- 蛋白酶抑制剂库
- 蛋白-蛋白互作(PPI)抑制剂库
- 细胞焦亡化合物库
- 小分子免疫肿瘤化合物库
- 线粒体靶向化合物库New
- 干细胞分化化合物库New
- 干细胞小分子化合物库
- 天然酚类化合物库New
- 天然萜类化合物库New
- TGF-beta/Smad信号通路库
- 中药化合物库
- 酪氨酸激酶抑制剂分子库
- 泛素化化合物库
- 定制化合物库-1
- 定制化合物库-2
- 定制化合物库-3
- 定制化合物库-4
- 定制化合物库-5
- 定制化合物库-6
-
定制您的化合物库
通过在我们的库存中挑选化合物来建立合适的化合物库,用于您的研究工作。
请通过info@selleck.cn与我们联系,定制你所需要的化合物库。
您可以选择:
- 抗体
- 生物试剂
- qPCR
- 2x SYBR Green qPCR Master Mix
- 2x SYBR Green qPCR Master Mix(Low ROX)
- 2x SYBR Green qPCR Master Mix(High ROX)
- 蛋白实验
- Protein A/G免疫沉淀磁珠
- Anti-DYKDDDDK Tag免疫磁珠
- Anti-DYKDDDDK Tag亲和凝胶
- Anti-Myc免疫磁珠
- Anti-HA免疫磁珠
- 磁力架
- Poly DYKDDDDK Tag多肽
- 细胞核与细胞浆蛋白抽提试剂盒
- 免疫磁珠
- 蛋白酶抑制剂Cocktail
- 蛋白酶抑制剂Cocktail(DMSO储液)
- 磷酸酶抑制剂Cocktail
- 新产品
- 联系我们
Mouse Naive CD4+ T Negative Selection Kit
产品描述
产品介绍:
小鼠初始CD4+ T阴性分选试剂盒可以实现轻松高效地从小鼠脾细胞中分离高纯度初始CD4+ T细胞(CD4+CD44lowCD62Lhigh)
应用范围:
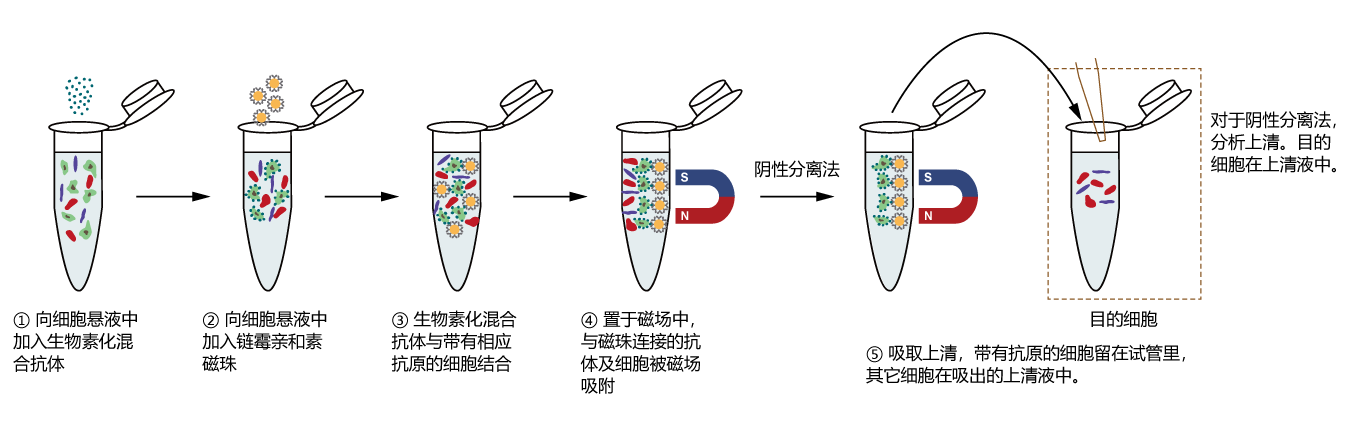
在该阴性选择过程中,非目的细胞被抗体复合物与磁珠标记。通过磁极将被磁珠标记的细胞与未被标记的目的初始CD4+ T细胞(CD4+CD44lowCD62Lhigh)细胞分离,从而实现小鼠初始CD4+ T细胞分选的目的。得到的小鼠初始CD4+ T细胞可进行流式细胞术、细胞培养或基于细胞的检测分析等下游应用。
产品优势:
操作简单、快捷,且无需分离柱;
纯度高达95%;
分选得到的细胞不带标记。
组分:
小鼠初始 CD4+ T 细胞分离抗体混合液,0.2 mL;
链霉亲和素磁珠,2 x 1 mL;
储存条件:
2 - 8°C储存。
实验步骤
实验前准备
分选 buffer 为含有 2 mM EDTA 和 2% 胎牛血清(FBS)的 PBS 或者含有 2mM EDTA 和 0.5% BSA 的 PBS,需预先通过 0.22 μm 滤膜过滤除菌。
实验步骤
1. 样本准备:
b. 离心完成后,弃上清,加入5 ml ACK 红细胞裂解液,室温裂解 5 min,再加入 20 ml PBS,500 g,离心 5 min。
注意:红细胞裂解步骤可根据所用裂解液不同调整用量及时间。少量红细胞残留不会影响后续分选及细胞纯度。
c. 离心完成后,弃上清,将脾细胞重悬于 PBS,细胞悬液用 70 μm 细胞筛网过滤后,计数。计数完成后,继续以 500 g,离心 5 min。
d. 离心完成后,弃上清,将细胞重悬于分选 buffer 中,调整细胞密度为 1×108 cells/ml。
2. 将 100 μl 细胞悬液(1×107 个细胞)加入无菌流式管底部,再加入2 μl Biotin-Ab Mix,混匀后 4℃ 孵育 10 min。
注意:加入细胞悬液时将细胞加入流式管底部,避免沿流式管管壁加入。根据所使用磁力架特点也可使用离心管进行细胞分选。如果分选更多细胞,则按比例增加 Biotin-Ab Mix 用量。
3. 孵育完成后,在流式管中加入 20 μl 链霉亲和素磁珠(使用前涡旋振荡重悬磁珠),混匀后 4℃ 孵育 10 min。孵育过程中应轻轻敲打管壁 1~2 次,防止细胞和磁珠沉降。
注意:如果分选更多细胞,则按比例增加链霉亲和素磁珠用量。例如分选 5×107 细胞,则应在 500 μl 细胞悬液中加入 10 μl Biotin-Ab Mix 和 100 μl 链霉亲和素磁珠。如果分选少于 1×107 个细胞,则将细胞悬液体积补至 100 μl,使用 2 μl Biotin-Ab Mix 和 20 μl 链霉亲和素磁珠。
4. 孵育完成后,在流式管加入 2.5 ml 分选 buffer,以移液器上下混合吹打 5 次混匀(避免剧烈振荡或者上下颠倒混匀)。
5. 将含有细胞的分选流式管置于磁力架上(若没有合适的磁力架,可将流式管中液体转移到 15 mL 离心管中再置于磁力架上),静置5 min。
6. 将细胞悬液倒入无菌离心管中(倾倒过程中流式管不要脱离磁力架)或用吸管吸入离心管中(勿将液体吸尽,防止吸到磁珠),500 g,离心5 min。细胞悬液中即包含纯化的小鼠初始CD4+ T细胞,离心后弃上清,收集细胞。
7. 根据实验需要洗涤细胞后,将细胞重悬于所需缓冲液或培养基中,即可用于后续分子生物学或细胞生物学实验。
以小鼠脾脏为例
a. 制备单细胞悬液:在 70 μm 细胞筛网上研磨脾脏,以预冷的 PBS 冲洗细胞筛网,收集细胞悬液于 50 ml 离心管中,500 g,离心 5 min。b. 离心完成后,弃上清,加入5 ml ACK 红细胞裂解液,室温裂解 5 min,再加入 20 ml PBS,500 g,离心 5 min。
注意:红细胞裂解步骤可根据所用裂解液不同调整用量及时间。少量红细胞残留不会影响后续分选及细胞纯度。
c. 离心完成后,弃上清,将脾细胞重悬于 PBS,细胞悬液用 70 μm 细胞筛网过滤后,计数。计数完成后,继续以 500 g,离心 5 min。
d. 离心完成后,弃上清,将细胞重悬于分选 buffer 中,调整细胞密度为 1×108 cells/ml。
2. 将 100 μl 细胞悬液(1×107 个细胞)加入无菌流式管底部,再加入2 μl Biotin-Ab Mix,混匀后 4℃ 孵育 10 min。
注意:加入细胞悬液时将细胞加入流式管底部,避免沿流式管管壁加入。根据所使用磁力架特点也可使用离心管进行细胞分选。如果分选更多细胞,则按比例增加 Biotin-Ab Mix 用量。
3. 孵育完成后,在流式管中加入 20 μl 链霉亲和素磁珠(使用前涡旋振荡重悬磁珠),混匀后 4℃ 孵育 10 min。孵育过程中应轻轻敲打管壁 1~2 次,防止细胞和磁珠沉降。
注意:如果分选更多细胞,则按比例增加链霉亲和素磁珠用量。例如分选 5×107 细胞,则应在 500 μl 细胞悬液中加入 10 μl Biotin-Ab Mix 和 100 μl 链霉亲和素磁珠。如果分选少于 1×107 个细胞,则将细胞悬液体积补至 100 μl,使用 2 μl Biotin-Ab Mix 和 20 μl 链霉亲和素磁珠。
4. 孵育完成后,在流式管加入 2.5 ml 分选 buffer,以移液器上下混合吹打 5 次混匀(避免剧烈振荡或者上下颠倒混匀)。
5. 将含有细胞的分选流式管置于磁力架上(若没有合适的磁力架,可将流式管中液体转移到 15 mL 离心管中再置于磁力架上),静置5 min。
6. 将细胞悬液倒入无菌离心管中(倾倒过程中流式管不要脱离磁力架)或用吸管吸入离心管中(勿将液体吸尽,防止吸到磁珠),500 g,离心5 min。细胞悬液中即包含纯化的小鼠初始CD4+ T细胞,离心后弃上清,收集细胞。
7. 根据实验需要洗涤细胞后,将细胞重悬于所需缓冲液或培养基中,即可用于后续分子生物学或细胞生物学实验。
技术支持
在订购、运输、储存和使用我们的产品的任何阶段,您遇到的任何问题,均可以通过拨打我们的热线电话400-668-6834,或者技术支持邮箱tech@selleck.cn,直接联系到我们。我们会在24小时内尽快联系您。
如果有其他问题,请给我们留言。
* 必填项



